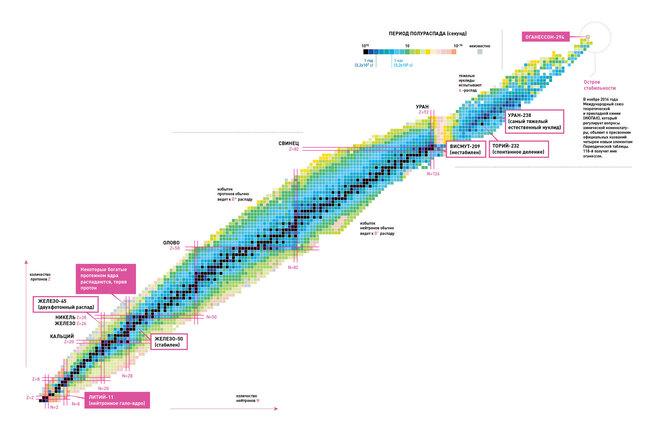
Limitele tabelului periodic al elementelor. Unde este insula fericită a stabilității?
Tabelul periodic al elementelor are o limită „superioară” - deci există un număr atomic teoretic pentru un element supergreu care ar fi imposibil de atins în lumea fizică cunoscută? Fizicianul rus Yuri Oganesyan, după care poartă numele elementului 118, consideră că o astfel de limită trebuie să existe.
Potrivit lui Oganesyan, șeful laboratorului Flerov de la Institutul Comun de Cercetare Nucleară (JINR) din Dubna, Rusia, existența unei astfel de limite este rezultatul unor efecte relativiste. Pe măsură ce numărul atomic crește, sarcina pozitivă a nucleului crește, iar aceasta, la rândul său, crește viteza electronilor în jurul nucleului, apropiindu-se de limita de viteză a luminii, explică fizicianul într-un interviu publicat în numărul din aprilie al revistei. . Un nou om de știință. „De exemplu, electronii cei mai aproape de nucleul din elementul 112 călătoresc cu 7/10 viteza luminii. Dacă electronii exteriori s-ar apropia de viteza luminii, s-ar schimba proprietățile atomului, încălcând principiile tabelului periodic”, spune el.
Crearea de noi elemente supergrele în laboratoarele de fizică este o sarcină plictisitoare. Oamenii de știință trebuie, cu cea mai mare precizie, să echilibreze forțele de atracție și repulsie dintre particulele elementare. Ceea ce este necesar este un număr „magic” de protoni și neutroni care „se lipesc împreună” în nucleul cu numărul atomic dorit. Procesul în sine accelerează particulele la o zecime din viteza luminii. Există o șansă mică, dar nu zero, de formare a unui nucleu atomic supergreu cu numărul necesar. Apoi, sarcina fizicienilor este să-l răcească cât mai repede posibil și să-l „prindă” în detector înainte ca acesta să se degradeze. Cu toate acestea, pentru aceasta este necesar să se obțină „materii prime” adecvate - izotopi rari, extrem de scumpi ai elementelor cu resursele de neutroni necesare.
În esență, cu cât un element din grupul transactinide este mai greu, cu atât durata sa de viață este mai scurtă. Elementul cu număr atomic 112 are un timp de înjumătățire de 29 de secunde, 116 - 60 de milisecunde, 118 - 0,9 milisecunde. Se crede că știința atinge limitele materiei posibile fizic.
Cu toate acestea, Oganesyan nu este de acord. El prezintă punctul de vedere că se află în lumea elementelor supergrele. „Insula stabilității”. „Timpul de dezintegrare al noilor elemente este extrem de scurt, dar dacă adăugați neutroni la nucleele lor, durata de viață a acestora va crește”, notează ea. „Adăugarea a opt neutroni la elementele numerotate 110, 111, 112 și chiar 113 le prelungește viața cu 100 de ani. o singura data".
Numit după Oganesyan, elementul Oganesson aparține grupului de transactinide și are număr atomic 118. A fost sintetizat pentru prima dată în 2002 de un grup de oameni de știință ruși și americani de la Institutul Comun de Cercetare Nucleară din Dubna. În decembrie 2015, a fost recunoscut ca unul dintre cele patru elemente noi de către Grupul de lucru comun IUPAC/IUPAP (un grup creat de Uniunea Internațională de Chimie Pură și Aplicată și Uniunea Internațională de Fizică Pură și Aplicată). Denumirea oficială a avut loc pe 28 noiembrie 2016. Oganesson ma cel mai mare număr atomic i cea mai mare masă atomică dintre toate elementele cunoscute. În 2002-2005, au fost descoperiți doar patru atomi din izotopul 294.
Acest element aparține grupei a 18-a a tabelului periodic, adică. gaze nobile (fiind primul său reprezentant artificial), totuși, poate prezenta o reactivitate semnificativă, spre deosebire de toate celelalte gaze nobile. În trecut, oganesson era considerat a fi un gaz în condiții standard, dar previziunile actuale indică o stare constantă de agregare în aceste condiții datorită efectelor relativiste pe care Oganessian le-a menționat în interviul citat mai devreme. În tabelul periodic, se află în blocul p, fiind ultima rădăcină a perioadei a șaptea.
Atât savanții ruși, cât și cei americani au propus din punct de vedere istoric nume diferite pentru el. În cele din urmă, însă, IUPAC a decis să onoreze memoria lui Hovhannisyan recunoscând marea sa contribuție la descoperirea celor mai grele elemente din tabelul periodic. Acest element este unul dintre cele două (de lângă seaborg) numite după o persoană vie.

